Giới thiệu công nghệ nano
Thuốc nano – Nanomedicine (Ứng dụng công nghệ nano trong y học) là một lĩnh vực tương đối mới và phát triển nhanh chóng kết hợp công nghệ nano với y sinh và dược học.1–3 Tiểu phân nano (NPs) có thể mang lại nhiều lợi ích về dược động học, hiệu quả, an toàn và mục tiêu điều trị khi chúng được đưa vào xây dựng công thức thuốc.1–5 Nhiều thuốc nano đã được sử dụng trong thực hành lâm sàng, và thậm chí nhiều thuốc đang được nghiên cứu trong các thử nghiệm lâm sàng cho những chỉ định khác nhau.2 Tuy nhiên, dược phẩm nano cũng đối mặt với những thách thức, chẳng hạn như cần thiết phải có các đặc tính tốt hơn, các vấn đề độc tính có thể xảy ra, thiếu các quy định hướng dẫn cụ thể, cân nhắc về chi phí – lợi ích và thiếu sự ủng hộ của một số chuyên gia chăm sóc sức khoẻ. 4,5 Với những lí do trên, những kỳ vọng về thuốc nano đang ở giai đoạn phát triển sớm hoặc các thử nghiệm lâm sàng cần phải thực tế.4
NHỮNG LỢI ÍCH CỦA THUỐC NANO
Nanomedicines và thuốc nano là gì?
Nanomedicine là một lĩnh vực tương đối mới và phát triển nhanh chóng kết hợp với công nghệ nano, y sinh và dược phẩm.1–3 Nanomedicine bao gồm dược phẩm nano, các tác nhân chẩn đoán hình ảnh nano (nanoimaging agents), và chẩn đoán trị liệu (theranostics).1,6 Bài báo này chỉ bàn về dược phẩm nano (ví dụ “thuốc nano”). Các thuốc nano có thể mang lại nhiều lợi ích sinh lí và sinh học, như làm tăng độ tan và dược động học (PK), tăng hiệu quả, giảm độc tính, và tăng tính chọn lọc mô so với các loại thuốc thông thường.1–6 Một số tranh cãi còn tồn tại liên quan đến định nghĩa của thuốc nano. Tuy nhiên Cục quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) xem các sản phẩm mà họ quản lí (bao gồm cả thuốc và chế phẩm sinh học) có kết hợp công nghệ nano nếu chúng chứa hoặc được sản xuất với: các tiểu phân nano từ 1 đến 100 nanomet (nm) – do kích thước nhỏ và diện tích bề mặt lớn này nên chúng thể hiện những khác biệt quan trọng so với nguyên liệu rời; hoặc nguyên liệu không nằm trong phạm vi kích thức trên nhưng vẫn thể hiện các đặc tính hoặc hiện tượng phụ thuộc vào kích thước tương tự.1,3,6 Tiểu phân nano có thể thay đổi các đặc tính sinh hóa, điện tử, từ tính và/hoặc quang học của một công thức thuốc theo một cách mà sau đó có thể được áp dụng cho mục đích điều trị.1,3,7 Tiểu phân nano được sử dụng trong công thức thuốc nano hiện nay bao gồm liposom, polyme, micell, tinh thể nano, kim loại / oxit kim loại và các vật liệu vô cơ và protein khác; mặc dù nghiên cứu đang được tiến hành với các loại tiểu phân nano khác, chẳng hạn như ống cacbon nano.
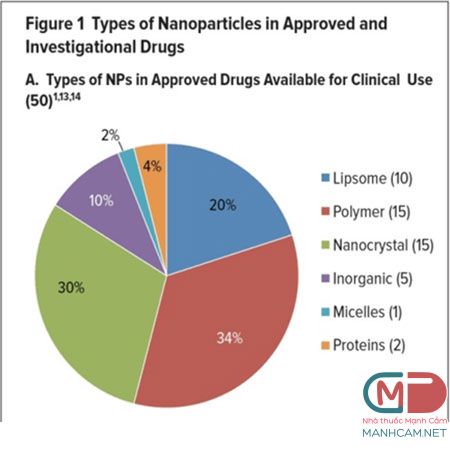
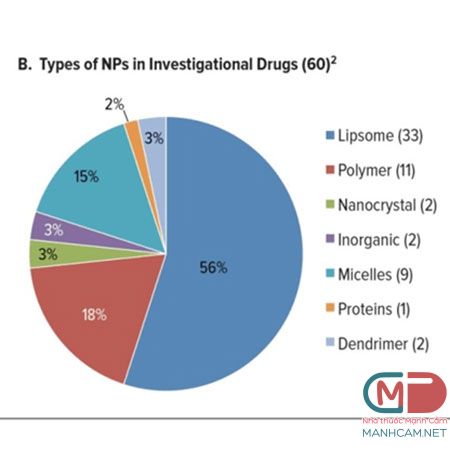
Hình dạng tiểu phân, kích cỡ và tính chất bề mặt của NP có ý nghĩa quan trọng trong việc xác định các tiêu chí dược động học quan trọng như hấp thu, hấp thụ tế bào, tích lũy và phân bố và các cơ chế giải phóng.1,3 Ngoài ra, tiểu phân nano có thể kết hợp để tạo thành một vector nhiều giai đoạn (a multistage vector), có thể tồn tại trong nhiều điều kiện hay các khoang khác nhau trong cơ thể sống mà nó đến và giải phóng.3,7 Cho đến nay, 50 dược phẩm nano đã được phê duyệt và có sẵn để sử dụng trong thực hành lâm sàng và thậm chí nhiều thuốc đang được nghiên cứu trong các thử nghiệm lâm sàng cho một loạt các chỉ định.4,5
NHỮNG LỢI ÍCH DƯỢC ĐỘNG HỌC TIỀM NĂNG
Một thực tế phổ biến trong việc phát triển các thuốc nano là kết hợp hoặc gắn một tác nhân trị liệu với các tiểu phân nano để thay đổi dược động học.3,5 Dược phẩm nano có thể khắc phục một số hạn chế của thuốc thông thường bằng cách làm tăng đặc tính dược động học và phân bố mong muốn, không phụ thuộc vào cấu trúc phân tử của hoạt chất.5 Chúng có thể được thiết kế để cho phép một thuốc tiếp cận nơi không thể đi vào được trước đó, lưu thông trong thời gian dài hơn để cho phép tích lũy lớn hơn hoặc được nhắm đến một vị trí bệnh.1,3,5,7 Sự kết hợp các tiểu phân nano trong một công thức thuốc cũng có thể thay đổi dữ liệu về nồng độ thuốc theo thời gian của một thuốc, cho phép giải phóng (và tiếp xúc với các mô bệnh và / hoặc mô bình thường) một cách có kiểm soát và bền vững.5 Hiện nay, hầu hết các loại thuốc nano trước đây đều được liên hợp với tiểu phân để cải thiện tính chất dược động học và/hoặc dược lực học (PD).1
Trong đa số các trường hợp, các thuốc kết hợp tiểu phân nano này sử dụng “nhắm mục tiêu thụ động”, liên quan đến sự tích lũy không đặc hiệu trong mô bệnh, thường là khối u.1 Tuy nhiên, “nhắm đích chủ động” có thể đạt được bằng cách gắn các phối tử (ví dụ, protein, kháng thể hoặc phân tử nhỏ) lên bề mặt liên hợp thuốc – tiểu phân nano, được thiết kế để gắn vào các thụ thể trên các tế bào cụ thể.1,3 Nhắm đích chủ động có thể dẫn đến sự gia tăng tích lũy thuốc trong tế bào và sự hấp thu bởi các tế bào của mô được nhắm đích.1Các nghiên cứu tiền lâm sàng và lâm sàng là cần thiết để mô tả dược động học, dược lực học, phân chia sinh học, hiệu quả và độc tính của các dược phẩm nano để hiểu chúng khác biệt như thế nào so với dạng thuốc thông thường.5 Những nghiên cứu này là cần thiết do công thức thuốc trong tiểu phân nano có thể làm thay đổi đáng kể dược động học.5 Ví dụ, dùng lipoxom doxorubicin liều 50 mg/m2 ở người làm tăng diện tích dưới đường cong (AUC) gấp 300 lần và làm giảm độ thanh thải gấp 250 lần so với thuốc bình thường.5
LỢI ÍCH HIỆU QUẢ
Khi xây dựng công thức thuốc nano, nhiều chiến lược đa dạng được áp dụng để cải thiện hiệu quả của thuốc. Chúng bao gồm: tận dụng kích thước nhỏ của NP để phá vỡ các hàng rào sinh lý quan trọng (hệ thống miễn dịch, giải phóng thận, suy thoái enzym và cơ học, v.v…); sử dụng tiểu phân nano để các phân tử thuốc được bảo vệ khỏi các môi trường bất lợi về sinh lý; và/hoặc sử dụng liên hợp bề mặt để nhắm mục tiêu thuốc đến các mô cụ thể, cho hiệu điều trị cao hơn tại một vị trí đích ngay cả khi sử dụng liều thấp hơn.6,7
Vật liệu nano cũng có tác dụng điều hòa miễn dịch có khả năng thúc đẩy hoặc hình thành đáp ứng miễn dịch thích nghi.8 Một số (ví dụ, tiểu phân nano polyme, liposom, vi nhũ tương và tiểu phân nano giống viruss) có khả năng xâm nhập vào các tế bào trình kháng nguyên.9,10 Khả năng này cho phép điều chỉnh đáp ứng miễn dịch, ví dụ, bằng cách gây ra đáp ứng loại Th1 chống lại tác nhân gây bệnh nội bào.9,10 Tiểu phân nano Poly-D, L-lactic acid-co-glycolic axit copolymer (PLGA) cũng đã được chứng minh là vận chuyển kháng nguyên tới tế bào đuôi gai. Với các phân tử hiệu quả và các đặc tính điều hòa miễn dịch tiềm tàng, việc sử dụng bổ sung tiểu phân có thể làm tăng hiệu quả của vắc-xin.8.Nhiều thuốc nano cũng có thể đóng vai trò trong việc cải thiện hiệu quả của miễn dịch ung thư vì chúng có thể được thiết kế để vận chuyển đúng nhịp, nhắm mục tiêu để tối đa hóa đáp ứng miễn dịch chống lại các tế bào cụ thể.2
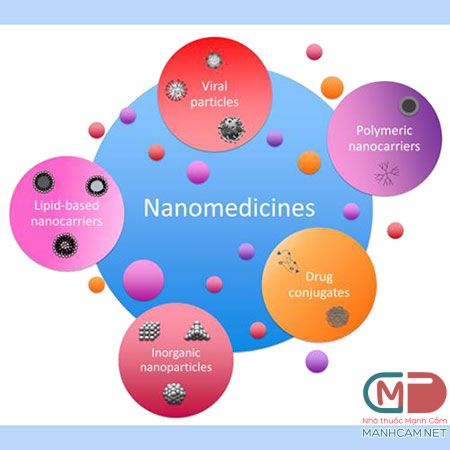
Nhiều thuốc nano đang được phát triển để điều trị ung thư.5 Trong hầu hết các trường hợp, các tiểu phân nano được sử dụng trong các công thức này nhắm vào một khối u hoặc thụ động hoặc chủ động, hoặc chúng hoạt động thông qua sự kết hợp của cả hai cơ chế (được gọi là hiệu ứng tăng cường tính thấm và tăng cường hiệu ứng [EPR]) cho phép ưu tiên tích lũy thuốc trong môi trường vi mô khối u.1,2,5,12 Ngược lại, hoạt động nhắm đích dựa vào các phối tử liên kết với các tiểu phân nano liên kết với các dấu ấn sinh học khối u. 2,5,6 Cơ chế này làm tăng sự tích lũy tiểu phân nano ở vị trí khối u và làm tăng sự phán đoán thụ thể đích tác dụng của tế bảo. 5,6 Nhiều nghiên cứu tiền lâm sàng và lâm sàng đã chỉ ra rằng các công thức nano có thể làm tăng tích lũy ở khối u một cách thụ động, làm giảm sự tiếp xúc mô bình thường.2 Tuy nhiên,kết quả lâm sàng về tiểu phân nano nhắm đích chủ động còn hạn chế và khó đạt được.5
Một cách khác, các công thức dược phẩm nano có thể có lợi cho việc điều trị ung thư là thông qua sự kết hợp các loại thuốc vào các tiểu phân nano có chu kỳ dài duy trì hoạt tính trong một khoảng thời gian giải phóng kéo dài.5 Do đó, các khối u bị phơi nhiễm lâu hơn với thuốc do tốc độ thải thuốc từ tiểu phân nano chậm và lưu giữ NP của thuốc trong lòng mạch.5
Lợi ích an toàn
Sự tích lũy thuốc tăng lên trong mô bệnh mà công thức nano mang lại có thể cho phép làm giảm liều hiệu quả của một loại thuốc, giảm bớt tác dụng phụ.7 Thường liều tiêm thuốc có kích thước angstrom tích lũy trong một vùng đích ít hơn 0.01%, so với 1% đến 5% cho tiểu phân nano.7Tích lũy cũng như giải phóng vào đích tác dụng có thể cho phép giảm liều, giảm tác dụng phụ.6,7 Trên thực tế, các thuốc nano đầu tiên được FDA chấp thuận dựa trên độc tính thấp hơn so với các công thức xây dựng thông thường.7 Doxil® (doxorubicin hydroclorid, Janssen), là thuốc nano được thiết kế công thức lần đầu tiên được FDA chấp thuận, có chỉ định điều trị sacom Kaposi ở những bệnh nhân nhiễm virus suy giảm miễn dịch ở người (HIV) vào năm 1995.1,2,6,7 Mặc dù hiệu quả như nhau, ưu điểm chính của nó so với doxorubicin thông thường được cho là giảm độc tính trên tim; tuy nhiên, Doxil có liên quan đến các tác dụng phụ liên quan đến công thức nano, chẳng hạn như vết ban đỏ gây mất cảm giác ở lòng bàn tay-bàn chân (palmar-plantar erythrodysesthesia) và hoạt hóa bổ thể – liên quan đến phản ứng dị ứng giả khi truyền.6,7 Hơn 20 năm sau khi được phê duyệt, Doxil vẫn được sử dụng rộng rãi cho chỉ định ban đầu của nó, cũng như điều trị ung thư buồng trứng, ung thư vú di căn và đa u tủy.6,7
Công thức nano cũng có thể giúp quản lý độc tính của thuốc liên quan các thuốc hóa trị liệu thông thường.1,2,5 Nhiều thuốc điều trị ung thư là không thân nước và tương đối không tan trong các dung dịch nước.27 Vì vậy, chúng thường yêu cầu các tác nhân có khả năng hòa tan nhưng gây độc khi dùng ngoài đường tiêu hóa (như dầu thầu dầu polyethoxylat [Kolliphor EL, BASF Corp.] cho paclitaxel). Do đó, các loại thuốc này thường yêu cầu giảm liều để kiểm soát độc tính trên toàn thân, gây hạn chế hiệu quả. Việc phát triển các hệ vận chuyển thuốc không yêu cầu các tác nhân hòa tan độc và công thức nano được xem như một giải pháp khả thi đối với các vấn đề liên quan đến việc sử dụng các thuốc hòa tan trong nước kém.
Vì những lý do này, công thức nano của nhiều hóa trị liệu đã được phê duyệt và nhiều thuốc đang trong phát triển lâm sàng. 2 Có lẽ đáng chú ý nhất là Abraxane (nab-paclitaxel, Celgene), một công thức của paclitaxel liên kết với tiểu phân nano albumin.4,5,7 Abraxane đã được FDA phê duyệt vào năm 2005 để điều trị ung thư vú di căn đã được điều trị trước đó và được chấp thuận những chỉ định cho những loại ung thư khác.4,5,7 Abraxane được dung nạp nhiều hơn so với paclitaxel thông thường, được chế tạo bằng Kolliphor EL.2,5,7 Tăng khả năng dung nạp (một phần do sự vắng mặt của dung môi độc hại) cho phép Abraxane được bệnh nhân sử dụng với liều cao hơn đáng kể, có khả năng đạt hiệu quả cao hơn,5,5,7
Nguồn: nhipcauduoclamsang