Đại phân tử sinh học có hiệu quả cao trong điều trị, tuy nhiên do sự phân hủy nhanh và khả năng hấp thu kém trong đường tiêu hóa nên phần lớn chúng phải chuyển sử dụng đường tiêm truyền. Lấy cảm hứng từ khả năng tự điều chỉnh tư thế của loài rùa báo (Stigmochelys pardalis), các nhà khoa học ở Viện công nghệ Massachusetts (MIT) đã phát triển một dụng cụ tự định hướng kích thước milimet (SOMA) có thể tự điều chỉnh vị trí để gắn vào mô niêm mạc đường tiêu hóa. Sau khi gắn, hệ đưa thuốc qua niêm mạc dạ dày. Các nhà khoa học ở MIT đã tiến hành nghiên cứu in vivo trên chuột và lợn, sử dụng insulin làm thuốc mẫu, chứng minh rằng SOMA cung cấp nồng độ thành phần dược phẩm hoạt tính tương đương với nồng độ thuốc tiêm dưới da.
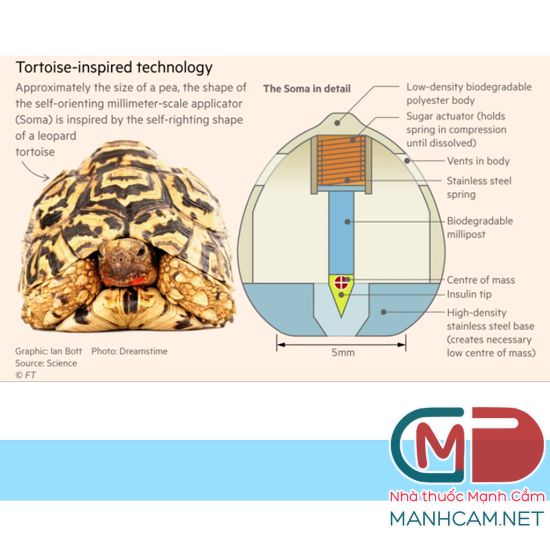
Quá trình phát triển
Vài năm trước, Traverso, Langer và các đồng nghiệp của họ đã phát triển một viên thuốc được bọc bằng nhiều kim nhỏ có thể được sử dụng để tiêm thuốc vào niêm mạc dạ dày hoặc ruột non.
Để tránh tiêm thuốc vào dạ dày, nơi thuốc có thể bị phá hủy bởi dịch dạ dày trước khi có tác dụng, các nhà khoa học đã thay đổi thiết kế dạng viên nang chứa SOMA, với 1 kim tiêm duy nhất. Đầu kim được làm từ insulin đông khô và trục của kim, được làm từ một vật liệu phân hủy sinh học khác, không đi vào thành dạ dày. Trong viên nang, kim được gắn vào một lò xo nén được giữ cố định bằng một đĩa làm bằng đường. Khi nuốt viên nang, nước trong dạ dày sẽ hòa tan đường, giải phóng lò xo và bơm kim vào thành dạ dày. Để đảm bảo thuốc được tiêm vào thành dạ dày, các nhà nghiên cứu đã thiết kế hệ thống của họ sao cho dù viên nang rơi vào dạ dày như thế nào, nó có thể tự định hướng để kim tiếp xúc với niêm mạc dạ dày. Các nhà nghiên cứu đã lấy cảm hứng từ tính năng tự định hướng từ loài rùa báo. Loài rùa này được tìm thấy ở châu Phi, có mai dạng mái vòm cao, dốc, cho phép nó tự điều chỉnh nếu nó nằm ngửa. Các nhà nghiên cứu đã sử dụng mô hình máy tính để đưa ra một biến thể của hình dạng này cho hệ đưa thuốc, cho phép nó tự định hướng lại ngay cả trong môi trường động của dạ dày. Sau khi đầu kim được tiêm vào thành dạ dày, insulin sẽ hòa tan với tốc độ có thể được kiểm soát bởi các nhà nghiên cứu khi viên nang được uống. Trong nghiên cứu này, phải mất khoảng một giờ để tất cả insulin được giải phóng hoàn toàn vào máu.
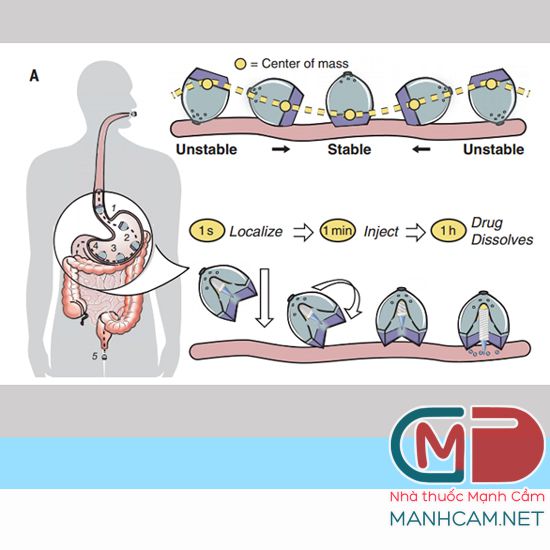
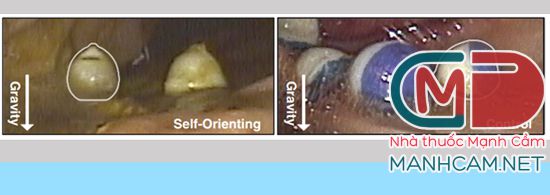
Tiềm năng của phương pháp mới
Trong các thử nghiệm ở lợn, các nhà nghiên cứu cho thấy họ có thể cung cấp thành công tới 300 microgam insulin. Gần đây, họ đã có thể tăng liều tới 5 miligam, tương đương với lượng bệnh nhân mắc bệnh tiểu đường type 1 cần tiêm. Sau khi viên nang giải phóng thuốc, nó có thể đi qua vô hại qua hệ thống tiêu hóa. Các nhà nghiên cứu tìm thấy không có tác dụng phụ từ viên nang, được làm từ các thành phần polymer và thép không gỉ phân hủy sinh học. Giáo sư Maria José Alonso ở khoa công nghệ sinh học và công nghệ dược phẩm tại Đại học Santiago de Compostela (Tây Ban Nha), mô tả viên nang mới là một “công nghệ hoàn toàn mới” có thể mang lại lợi ích cho nhiều bệnh nhân. Nhóm MIT hiện đang tiếp tục hợp tác với Novo Nordisk để phát triển hơn nữa công nghệ và tối ưu hóa quy trình sản xuất cho các viên nang. Họ tin rằng loại phân phối thuốc này có thể hữu ích cho bất kỳ loại thuốc protein nào thường phải tiêm, chẳng hạn như thuốc ức chế miễn dịch được sử dụng để điều trị viêm khớp dạng thấp hoặc bệnh viêm ruột. Nó cũng có thể hiệu quả đối với các acid nucleic như DNA và RNA.