Hiện nay, việc chia sẻ trên mạng xã hội khá dễ dàng dẫn đến nhiều thông tin không chính xác về cách điều trị bệnh nhất là ung thư nhằm mục đích trục lợi hoặc do thiếu kiến thức chuyên môn. Có rất nhiều thông tin sai lệch về hướng “bỏ đói ung thư” như kiêng đường, kiêng đạm động vật, kiêng sữa sẽ làm giảm kích thước, điều trị dứt điểm ung thư. Vậy đâu là cách hiểu đúng đắn và hiệu quả của phương pháp “bỏ đói ung thư” dưới góc nhìn khoa học như thế nào?
“Bỏ đói ung thư” dưới bản chất khoa học như thế nào?
Tế bào ung thư khác tế bào thường ở chỗ nó có khả năng phân chia vô hạn, xâm lấn các mô xung quanh và cuối cùng là di căn đến các mô cơ quan xa vị trí khởi phát. Để phục vụ cho tăng trưởng nhanh, tế bào ung thư phải sử dụng một lượng lớn năng lượng được chuyển hóa từ các chất dinh dưỡng như glucose, amino acid và acid béo. Đây là các chất đơn giản đã được cơ thể phân cắt và hấp thụ từ nguồn thực phẩm mà chúng ta tiêu thụ hằng ngày. Do đó, kiêng 1 loại chất dinh dưỡng nhất định (như đường hay đạm) không thể “bỏ đói” ung thư, vì cơ thể luôn có cơ chế chuyển hoá qua lại giữa đạm-đường-béo, hoặc giữa các chất trong cùng một nhóm chất như giữa các loại đường, các loại amino acid và acid béo với nhau.
Để sử dụng ba nhóm chất cơ bản này (đường, đạm, béo), tế bào nào cũng phải phân giải thành các thành phần nhỏ hơn nữa, và chúng cũng dễ dàng chuyển hoá qua lại với nhau, do đó nếu thiếu hụt hoặc mất 1 trong 3 loại chất trên thì nó cũng có cách tổng hợp lại hoặc sử dụng năng lượng từ việc phân giải nguồn khác.
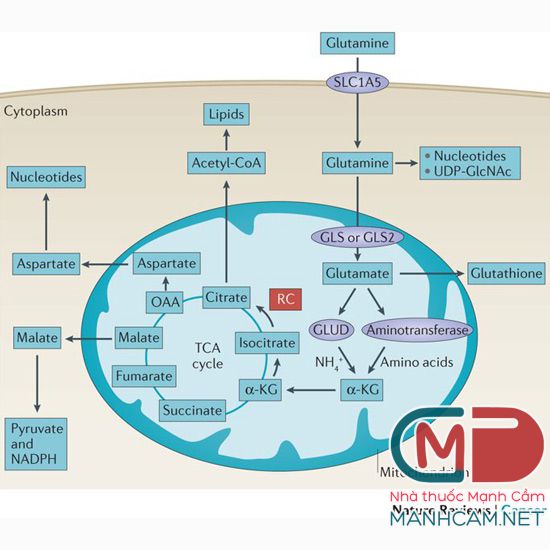
Ví dụ, glutamine là một amino acid có trong hải sản, thịt đỏ, bắp cải tím và tế bào ung thư sử dụng glutamine cho tổng hợp nucleotide, có khả năng tạo năng lượng thông qua việc biến đổi thành glutamate và alpha-ketoglutarate để đi vào chu trình TCA tạo ATP (Hình minh họa 1). Các sản phẩm trung gian trong chu trình TCA có thể tham gia vào việc tổng hợp chất béo, protein hoặc các amino acid khác. Trong một số trường hợp, khi không có glucose, tế bào ung thư có thể sử dụng glutamine để phục vụ cho quá trình tăng trưởng và phát triển (7). Ở trường hợp này, ngay cả khi hạn chế đường trong lượng dinh dưỡng nạp vào thì tế bào ung thư vẫn có thể lấy glutamine làm nguồn năng lượng.
Vì vậy, trong điều trị và phòng ngừa ung thư, không bao giờ cắt hẳn được một nguồn dinh dưỡng nào đó, vì không có thực phẩm nào không chứa đạm, đường hoặc béo. Việc kiêng cữ một cách cực đoan chỉ làm tăng các yếu tố nguy cơ, chậm quá trình hồi phục trong và sau điều trị do thiếu các chất thiết yếu khác mà cơ thể không tổng hợp được hoặc tổng hợp kém.
Vậy, “bỏ đói ung thư” thật sự là như thế nào?
Cùng với các phương pháp điều trị ung thư đã phổ biến như xạ trị, hóa trị, phẫu thuật thì hiện nay phương pháp “bỏ đói ung thư” cũng cho thấy tín hiệu khả quan. “Bỏ đói ung thư” thực chất là ngăn sự cung cấp chất dinh dưỡng cần thiết cho sự phát triển của tế bào ung thư thông qua:
- Cắt giảm số lượng và kích thước các mạch máu tới nuôi khối u. Hoặc
- Ức chế các kênh vận chuyển chất dinh dưỡng trên màng tế bào hoặc quá trình chuyển hoá dinh dưỡng mà các tế bào ung thư sử dụng khác với tế bào thường.
Chưa hề có phương pháp bỏ đói nào liên quan đến việc cắt khẩu phần ăn.
Các phương pháp “bỏ đói ung thư” mà khoa học đã chứng minh tính hữu hiệu
a/ Tấn công gián tiếp lên các “mạch máu” vận chuyển dinh dưỡng
Hình thành mạch máu mới là một trong các đặc điểm chính của khối u (1). Giống như các mô bình thường, các khối u cần có các chất dinh dưỡng và oxy cũng như khả năng loại bỏ các chất thải và CO2 trong quá trình chuyển hóa. Một trong các protein thúc đẩy sự hình thành mạch máu mới được biết đến sớm nhất là VEGF (vascular endothelial growth factor).. Đặc biệt, VEGF có thể được sinh ra ngay cả trong điều kiện thiếu oxy (1).
Gần đây, có nhiều tín hiệu khả quan của các nghiên cứu trong phòng thí nghiệm, tiền lâm sàng (thí nghiệm lên động vật) và một số thuốc đã qua thử nghiệm lâm sàng cho thấy sự ức chế hình thành mạch máu mới có khả năng ức chế khối u phát triển.
Có thể tham khảo bảng 1 (6) cho các thuốc đã được FDA chấp nhận theo hướng bỏ đói ung thư bằng cách ức chế VEGF.
Bảng 1: Các thuốc theo hướng bỏ đói ung thư bằng ức chế VEGF đã được FDA chấp nhận (6)
| Cơ chế | Thuốc | Tên thương mại | Chỉ định |
| kháng thể đơn dòng vô hiệu hóa VEGF (VEGF-A) | Bevacizumab | Avastin | Ung thư đại trực tràng di căn, ung thư phổi không tế bào nhỏ, ung thư biểu mô buồng trứng, ung thư ống dẫn trứng, ung thư cổ tử cung, ung thư phúc mạc nguyên phát, u nguyên bào thần kinh đệm đa dạng. |
| Protein dung hợp tái tổ hợp (recombinant fusion BEGF protein) VEGF (VEGF-A, VEGF-B, PLGF) | aflibercept | Zaltrap | Ung thư đại trực tràng di căn |
| Kháng thể đơn dòng kháng VEGFR2 | Ramucirumab | Cyramza | Ung thư đại trực tràng di căn, , ung thư phổi không tế bào nhỏ, ung thư dạ dày |
| kháng thể vô hiệu hóa nhiều loại thụ thể tyrosine kinase (VEGFRS, PDGFRs, RAF, KIT, FLT3, RET) | sorafenib | Nexavar | Ung thư biểu mô tế bào thận, ung thư biểu mô tế bào gan, ung thư tuyến giáp. |
| kháng thể vô hiệu hóa nhiều loại thụ thể tyrosine kinase (VEGFRS, PDGFRs, FLT3, RET, CSF1R) | Sunitinib | Sutent | Ung thư biểu mô tế bào thận, Pancreatic neuroendocrine tumors, u mô đệm đường tiêu hóa. |
| kháng thể vô hiệu hóa nhiều loại thụ thể tyrosine kinase (VEGFRS, PDGFRs, FGFRs, TIE2, RAF, KIT, RET) | regorafenib | Stivarga | U mô đệm đường tiêu hóa, Ung thư đại trực tràng di căn, ung thư biểu mô tế bào gan |
| kháng thể vô hiệu hóa nhiều loại thụ thể tyrosine kinase (VEGFRS, PDGFRs, FGFR1-2, c-Kit) | pazopanib | Votrient | Ung thư biểu mô tế bào thận, ung thư mô mềm liên kết ( soft tissue sarcoma) |
| kháng thể vô hiệu hóa nhiều loại thụ thể tyrosine kinase (VEGFRS, PDGFR, c-Met, AXL) | axitinib | Inlyta | Ung thư biểu mô tế bào thận |
| kháng thể vô hiệu hóa nhiều loại thụ thể tyrosine kinase (VEGFRS, EGFRs, RET) | vandetanib | Caprelsa | Ung thư tuyến giáp thể tủy. |
| kháng thể vô hiệu hóa nhiều loại thụ thể tyrosine kinase (VEGFRS, PDGFRa, FGFRs,RET, c-Kit) | Lenvatinib | Lenvima | Ung thư biểu mô tế bào thận, ung thư tuyến giáp. |
| kháng thể vô hiệu hóa nhiều loại thụ thể tyrosine kinase (VEGFRS, Tie2, c-Met, AXL) | Cabozantinib | Cometriq | Ung thư tuyến giáp thể tủy, ung thư biểu mô tế bào thận. |
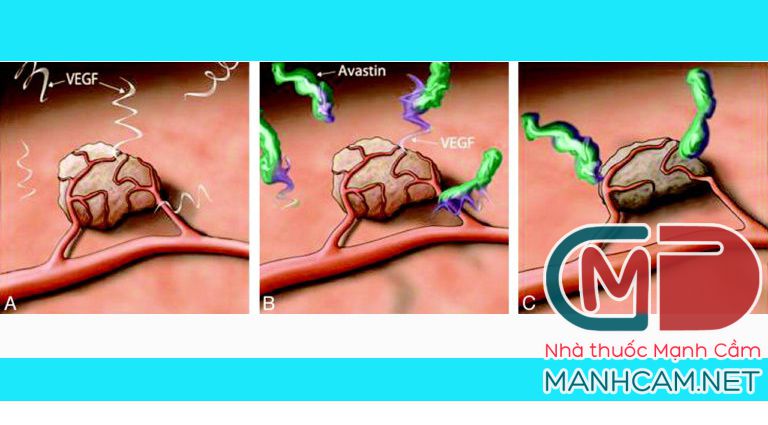
Một ví dụ điển hình là: Năm 2005, Ferrara và cộng sự đã thiết kế một kháng thể đơn dòng tái tổ hợp đầu tiên có thể khóa protein VEGF-A, làm đói tế bào ung thư là bevacizumab (tên thương mại là Avastin) (Hình minh họa 2). Avastin đã được FDA chấp nhận và được ứng dụng trong chữa trị một số loại ung thư như ung thư đại trực tràng, ung thư cổ tử cung, ung thư phổi không tế bào nhỏ, glioblastoma, ung thư biểu mô tế bào thận… Tiêm tĩnh mạch bevacizumab sẽ loại bỏ VEGF trong dòng máu và mạch máu, ức chế sự tương tác của VEGF và thụ thể của nó (2-5). Một số nghiên cứu lâm sàng cho thấy kết hợp hóa trị với bevacizumab làm tăng thời gian sống ở bệnh nhân ung thư đại trực tràng đã di căn (metastatic colorectal cancer), ung thư cổ tử cung, ung thư phổi không tế bào nhỏ (9). Mặc dù vậy, bevacizumab đã thất bại trong việc kéo dài thời gian sống ở bệnh nhân ung thư vú, melanoma, và ung thư tuyến tụy. (9).
b/ Tấn công trực tiếp đến các chất mà tế bào ung thư hấp thu nhiều
Một chiến lược khác bên cạnh phương pháp ức chế sự hình thành mạch máu mới là sử dụng thuốc loại bỏ các chất dinh dưỡng cần thiết cho tế bào ung thư. Một số ít đã được FDA chấp thuận để chữa trị cho bệnh nhân ung thư, và nhiều thuốc đang còn đang trong quá trình thử nghiệm tiền lâm sàng hoặc lâm sàng. Các thuốc đã được chấp nhận có thể kể đến như L- Asparaginase (Elspar) cho ung thư bạch cầu lympho ác tính, CB-839 kết hợp với cabozantinib trong điều trị bệnh nhân ung thư biểu mô tế bào thận. Các tế bào bach cầu lympho ác tính không thể tự tổng hợp asparaginase như tế bào bình thường và L-aspaginase phân cắt asparagine dẫn đến việc thiếu chất dinh dưỡng cho tế bào ung thư. Hơn nữa, quá trình Aspraraginase xúc tác việc chuyển đổi của L-asparagine thành aspartic acid và ammonia-một chất gây độc tế bào. Glutamine cũng là một chất thiết yếu cho tế bào ung thư, do đó chiến lược phát triển thuốc nhằm ức chế sự chuyển hóa hoặc kênh vận chuyển glutamine đang được đẩy mạnh nghiên cứu (xem bảng 2) (7).
Bảng 2: Chiến lược phát triển các thuốc hoặc hợp chất tác động lên việc chuyển hóa glutamine trong ung thư (7).
| Phân loại | Thuốc | Tình trạng nghiên cứu |
| Glutamine mimic(Các phân tử thuốc được thiết kế có cấu trúc tương đối giống với glutamine) | DONAzeserine
Acivicin |
|
| Loại bỏ glutamine | L-Asparaginase |
|
| Chất ức chế GLS (Kidney-type glutaminase – Gluatminase thể thận) | 968BPTES
CB-839 |
|
| Chất ức chế SLC1A5 | BenzylserineGamma-FBP
GPNA |
|
| Chất ức chế GLUD | EGCGR162 |
|
| Chất ức chế aminotransferase | AOA |
|
| Chất ức chế SLC7A11 hoặc hệ thống xCT | SulfasalazineErastin |
|
Ngoài ra việc kiểm soát các chất dinh dưỡng thông qua khẩu phần ăn, hạn chế lượng calorie, protein, amino acid nạp vào, ăn uống lành mạnh nhiều rau xanh, trái cây và tăng cường hoạt động thể chất cũng mang lại hiệu quả điều trị, làm chậm sự phát triển của tế bào ung thư (8). Điều này cũng được khuyến khích ở các bệnh nhân tiểu đường hay béo phì (8).
Kết luận
Việc loại bỏ hoàn toàn các chất dinh dưỡng từ khẩu phần ăn là không thể vì tế bào thường hay ung thư đều có khả năng chuyển hóa qua lại giữa đường-béo-đạm, và vì thực phẩm nào cũng có đủ các loại chất cơ bản dù ít dù nhiều. Hơn thế nữa, việc kiêng khem quá mức các chất dinh dưỡng trong một thời gian dài cũng gây nên một số bệnh lí và giảm sức đề kháng. Tuy nhiên, điều đó không có nghĩa là không cần hạn chế gì cả trong và sau điều trị. Những thực phẩm có các chất gây viêm (như N-glycolylneuraminic acid (Neu5Gc) trong thịt đỏ), hoặc các chất carcinogenic (như một số aldehyde mạch ngắn trong dầu ăn bị sốc nhiệt (chiên xào nướng) hay cồn trong rượu bia),… vẫn cần phải hạn chế. Điều này đúng cho cả việc phòng bệnh.
Tóm lại, dinh dưỡng đóng vai trò quan trọng trong điều trị, nhưng ở mặt giúp cơ thể phục hồi nhiều hơn là mặt điều trị (8).
http://ruybangtim.com
[spoiler title=’Tài liệu tham khảo’ style=’orange’ collapse_link=’false’]1. Douglas Hanahan and Robert A. Weinberg. Hallmarks of Cancer: The Next Generation .Cell 144, March 4, 2011.
2. Ferrara N, Hillan KJ, Novotny W: Bevacizumab (Avastin), a humanized anti-VEGF monoclonal antibody for cancer therapy. Biochem Biophys Res Commun 2005;333:328-335.
3. Ferrara N, Kerbel RS: Angiogenesis as a therapeutic target. Nature 2005;438:967-974.
4. Ferrara N, Gerber HP, LeCouter J: The biology of VEGF and its receptors. Nat Med 2003;9:669-676.
5. William Novotny et al.Discovery and development of bevacizumab, an anti-VEGF antibody for treating cancer. Nature Reviews Drug Discovery volume3, pages391–400 (2004).
6. Zirlik K, Duyster J. Anti-Angiogenics: Current Situation and Future Perspectives. Oncol Res Treat 2018;41:166-171. https://doi.org/10.1159/000488087.
7. Brian J. Altman, Zachary E. Stine & Chi V. Dang. Nature Reviews Cancer volume16, pages619–634 (2016).
8. Lawrence H. Kushi et al. ACS Guidelines on Nutrition and Physicial Activity for Cancer Prevention. CA CANCER J CLIN 2012;62:30–67.
9. Gordon C Jayson, Robert Kerbel, Lee M Ellis, Adrian L Harris,. Antiangiogenic therapy in oncology: current status and future directions,The Lancet,Volume 388, Issue 10043, 2016, Pages 518-529, ISSN 0140-6736, https://doi.org/10.1016/S0140-6736(15)01088-0.
10. Brian J. Altman, Zachary E. Stine & Chi V. Dang,. From Krebs to clinic: glutamine metabolism to cancer therapy, Nature Reviews Cancer 2016, 16, pages619–634 (2016). DOI: https://www.nature.com/articles/nrc.2016.71
11. S.K. Mukherji, American Journal of Neuroradiology February 2010, 31 (2) 235-236; DOI: https://doi.org/10.3174/ajnr.A1987[/spoiler]