Chức năng quan trọng nhất của da là nó như một rào càn ngăn cách và bảo vệ hiệu quả cơ thể với bên ngoài. Lớp thượng bì không chỉ bảo vệ da khỏi những tác động vật lý hóa học và sinh hóa mà còn đóng vai trò như một hàng rào miễn dịch.
Vai trò quan trọng nhất của hàng rào vật lý không phải ở nucleated mà là các (cytoskeletal proteins) và mối liên kết giữa tế bào cell-cell junctions và một phần lớp sừng.
Về rào cản hóa học và sinh hóa thì là các lipid, axit, enzyme thủy phân (hydrolytic enzymes), các peptide kháng khuẩn (antimicrobial peptides) và đại thực bào (macrophages). Hàng rào miễn dịch được cấu thành từ các dịch thể của hệ thống miễn dịch và các tế bào miễn dịch (The skin an indispensable barrier).
Sự lão hóa da là sự hợp giữa các yếu tố lão hóa sinh (intrinsic aging) của sự di truyền và các yếu tố bên ngoài như sự tiếp xúc điều kiện môi trường ô nhiễm và ánh nắng mặt trời gây lão hóa ánh sáng (photoaging), các yếu tố trong ngoài tác động lặp di lặp lại ảnh hưởng đến cấu trúc da từ thượng bì cho đến hạ bì. Các nghiên cứu hiện tại về lão hóa da đã tập trung chủ yếu vào việc xử lý việc suy giảm chất nền ngoại bào như gelatin và các sợi đàn hồi của lớp hạ bì.
Vai trò quan trọng nhất của chất nền ngoại bào (ECM – Extracellular Matrix) của lớp trung bì là duy trì đặt tính và tính chất sinh hóa của mô da. Các tế bào tạo nên các mô này đáp ứng cho quá trình sinh tổng hợp các thành phần chất nền ngoại bào. Sự tương tác của tế bào với chất nền ngoại bào là kết quả của sự hoạt động của các biểu mô kháng nguyên (specific receptor) của các thụ thể đặc hiệu của tế bào (epitops). Receptor và epitopes điều chỉnh và kích thích sự biệt hóa của các tế bào, cũng như sự hoạt động của gen của các protein cụ thể, cũng như kết nối và di chuyển tế bào.
Collagen là thành phần quan trọng của mô liên kết có vai trò duy trì tính ổn định của chu kỳ. Trong thập kỷ qua đã có nhiều nghiên cứu về enzyme phân hủy collagen và họ protein collagen. Họ collagen protein có hình dạng giống với dây xoắn trong đó ba phân tử Polypeptide được xoắn thành ba chuỗi triplet-helix. collagen này chiếm phần lớn mô liên kết trong cơ thể như sụn và da.
Kiến trức về quá trình trao đổi chất và các cấu trúc phân tử của nhiều chủng loại khác nhau collagen ở trong toàn bộ cá thể, mô, tế bào đều rất quan trọng trong việc hiểu quá trình phát triển và bệnh của con người. Ngoài ra, nó không những sản sinh ra collagen mà còn hiểu được cơ chế liên quan đến phân hủy collagen để có thể đảo ngược quá trình lão hóa thông thường và tái tạo mô.
Phân hủy collagen là một trong những yếu tố hình thành của chất nền ngoại bào (ECM) là một quá trình quan trọng trong hồi phục vết thương (repair) và tái tạo mô (tissue remodeling), hình thành hình dạng (morphogenesis). Nếu quá trình này sai có thể dẫn đến nguyên nhân của những xơ hóa, loét mãn tính, viêm thận, viêm khớp dạng thấp, ung thư. Sự phân hủy của chất nền ngoại bào hoạt động khác nhau tùy thuộc vào loại protein, trong đó quan trọng nhất là sự hình thành chất nền metallicoproteinase (MMPs), được gọi là matrixin.
Matrix Metalloproteinase là các protein được liên kết bởi 130-260 amino acid với các vị trí chất xúc tác ion kim loại giống như kẽm (Zn2+) và canxi (Ca2+). Matrix Metalloproteinase là báo cáo đầu tiên phát hiện enzyme phân hủy collagen và phá vỡ protein. Matrix Metalloproteinase đặc trưng bởi có Met-turn chứa amino acid (Met) Methionine và vị trí chung liên kết kèm (zinc) dài chứa ion kẽm (Zn2+) có tác dựng tương tác với dư lượng Met được bảo tồn và vị trí Tris (histidine)
Cho đến nay có 24 MMPs liên quan chức năng và cấu trúcở động vật có vú và đang phân bố ở tế bào và các cơ quan như Stromelysin, genlatinase, collagénase.
Cấu trúc nền Matrix Metalloproteinase được biểu thị bằng số ví dụ từ MMP-2 đến MMP- 28 và không bao gồm MMP-4, MMP-5, MMP-6, MMP-22. cấu trúc nền Matrix Metalloproteinase có tham gia vào tái tạo lại các mô liên kết, chữa lành vết thương (wound healing), tạo mạch máu (angiogenesis) , tăng trưởng xương (bone growth) , sự hình thành phổi (embryogenesis), cấy mầm dinh dưỡng trophoblast (trophoblast implantation).
Biểu hiện gen của Matrix Metalloproteinase được quan sát thấy ở tế bào nội mô mạch máu (endothelial cells), đại thực bào (macrophage), Bạch cầu monocytes (monocytes), bạch cầu trung tính (neutrophils) và nguyên bào sợi (fibroblast) giữa các tế bào mô liên kết.
Các hoạt động sinh học của Matrix Metalloproteinase là điều tiết sự ức chế của hoạt động enzyme, ức chế phản ứng chất xúc tác của enzyme hoạt động, hoạt động của dạng pro enzyme (Pro-enzymatic form activation, pro-MMP. Tiên chất không hoạt động của enzyme (zymogens) sự điều tiết bài tiết bởi các tế bào của MMP, điều chỉnh một nửa MMP mRNA phiên mã gen.
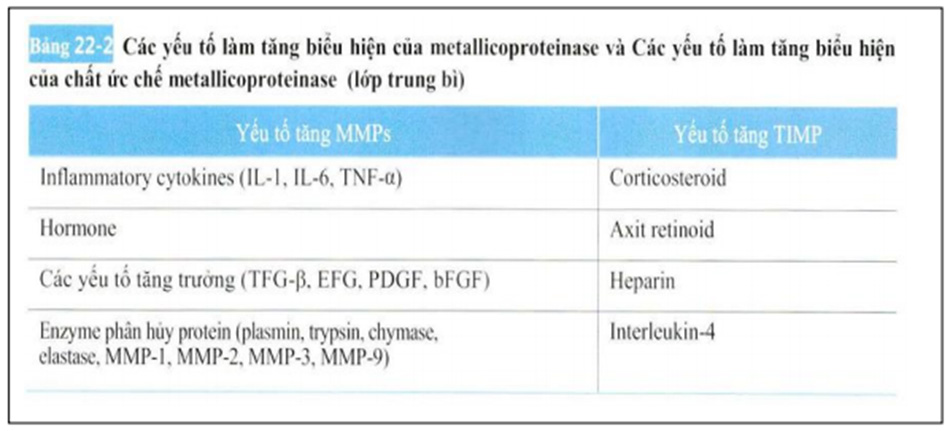
Matrix Metalloproteinase cũng điều chỉnh nội tiết tố thần kinh. Biểu hiện của Matrix Metalloproteinase luôn duy trì mức thấp trong các mô. Sự điều chỉnh phiên mã ở cấp tế bào bị ảnh hưởng bởi các nguyên tố vật lý như tia cực tím bên ngoài, sự tương tác qua lại (tế bào – tế bào, tế bào – ma trận ngoại bào), hormone, cytokine, yếu tố tăng trưởng. Sự kích hoạt và ức chế Matrix Metalloproteinase là quá trình điều tiết diễn ra liên tục. Các yếu tố làm tăng biểu hiện của Matrix Metalloproteinase giống như sau.
Biểu hiện của các cytokines gây viêm – chất ức chế Matrix Metalloproteinase (MMP-inhibitor, MMPI) , yếu tố tăng trưởng nguyên bào sợi [TFG-beta] , yếu tố tăng trưởng có nguồn gốc tiểu cầu [PDGF], yếu tố tăng trưởng biểu bì (EGF),yếu tố tăng trưởng và hormone ( biến đổi yếu tố tưng trường beta [TFG-beta], yếu tố hoại tử u alpha , Interleukin-6 , Interleukin-1) được tạo bởi Interleukin-4, heparin, Axit retinoid, Corticosteroid.
Matrix Metalloproteinase được kích hoạt trực tiếp bởi hoạt động của (plasmin, trypsin, chymase, elastase, collagenase kẽ (MMP-1), chất nền metallicoproteinase-2(MMP-2), MMP-8, MMP-9.
Phản ứng với sự kích hoạt cục bộ của hệ thống enzyme (Chất nền loại màng metallicoproteinase-l (Membrane-Type MMPs), MT-MMPs) Matrix Metalloproteinase của dạng màng tế bào. Đặc tính phân giải protein của Matrix Metalloproteinase được điều tiết thông qua hoạt hóa chất xúc tác hoặc bất hoạt pro-MMP thông qua (chất ức chế mô nội sinh Metalloproteinases. TIMPs) chất úc chế mô của Matrix Metalloproteinase. Trong huyết thanh Alpha-1 antiproteinase và Alpha 2 Macroglobulin đảm nhiệm vai trò quan trọng nhất của chất ức chế phân giải protein trong các mô , 4 TIMPs ức chế Matrix Metalloproteinase đã được hoạt hóa hoặc chuyển đổi hay hoạt hóa bàng MMP ở dạng proMMP. Sự biểu hiện của TIMP là để điều chỉnh sự tăng trưởng và cytokine.
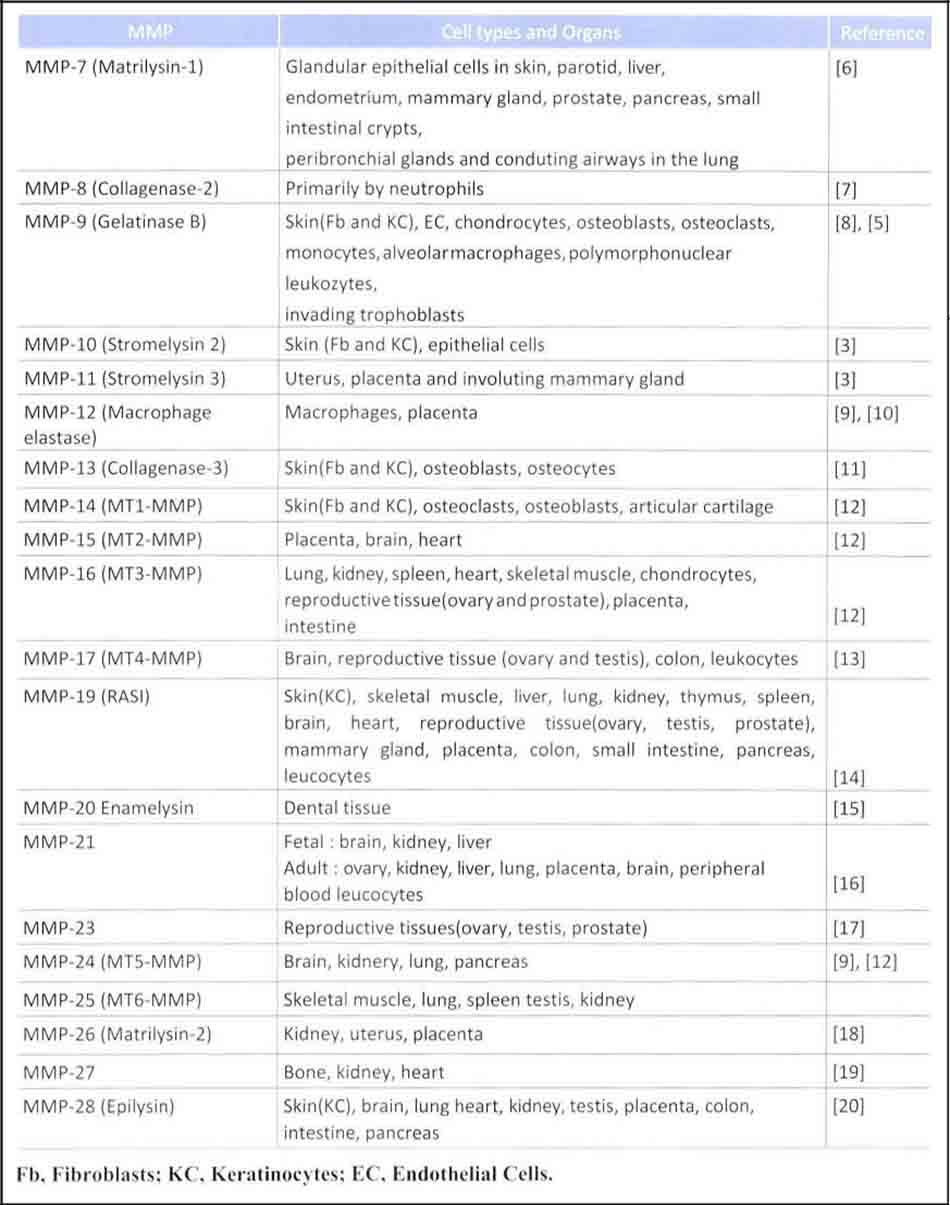
MMPs nếu nhìn cấu tạo chất ức chế mỏ của Matrix Metalloproteinase (TIMPs) và Metalloproteinase (MMPs) thì cấu tạo có 4 miền mang tính điển hình. Đầu tiên là miền Propeptide chiều dài là 80 cái amino acid và chứa Motif chuyển đổi Cystein.
Thứ hai. miền chất xúc tác (catalytic domain) được tạo thành bằng độ dài khoảng 170 cái amino acid. Phần này có 2 ion kẽm ( I cái mang vai trò chất xúc tác, 1 cái mang vai trò ổn định cấu trúc). Miền chất xúc tác này chứa cấu tạo ‘Met- turn’. Cystein của mien Propeptide chặn sự tương tác VỚI các phân tử nước để tương tác VỚI các ion kẽm đóng vai trò như một chất xúc tác. Vì vậy nó làm bất hoạt MMP cho đến khi gỡ bỏ miền Propeptide. Thứ ba, cấu tạo của Matrix Metalloproteinase là một vị trí liên kết có độ dài đa dạng. Cuối cùng, miền haemopexin có chiều dài là 200 cái amino acid. Mien haemopexin khi mà Matrix Metalloproteinase tác động vào thì sẽ hình thành trạng thái cấu trúc nước đảo cánh quạt. Miền Haemopexin là cấu trúc nước đặc trưng của Matrix Metalloproteinase
Disintegrin matrix metalloproteinase (ADAMs) là một phần họ adamalysin của enzyme metzincin. cấu trúc của Disintegrin matrix metalloproteinase có cấu trúc bằng các tiêu đơn vị tương tự nhau và MTMMPs. Miền Haemopexin được thay thế và bao gồm miền Disintegrin và lặp lại của vị trí tương tự như yếu tố tăng trưởng biểu bì (EGF), vị trí giàu Cysteine. Miền được bổ sung này cung cấp khả năng tác động hoặc là kết hợp với các chất của những tế bào xung quanh.
TIMP được cấu tạo gồm 2 miền (Một là của miền amino-terminal, Một là của miền carboxy- terminal) và cấu tạo từng miên được kết nối bởi ba liên kết đôi ss. Đâu cuối N (N-tenninal) ức chế MMPs bằng phản ứng ở vị trí oxi hóa của MMPs và một rãnh nhăn đặc biệt tự sinh ra (fold). (Hình 22-1).
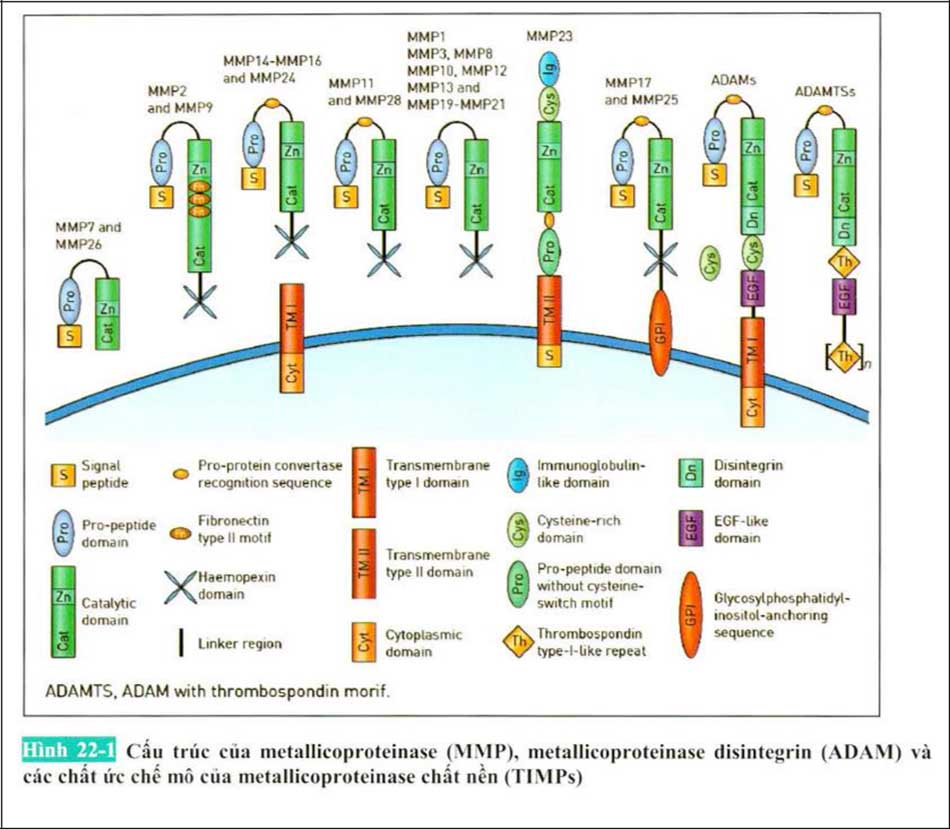
Ở phiên mã bởi các Cytokine và tế bào miễn dịch. MMPs được dịch thành zymogen (tiền chất không hoạt động của enzyme) được vô hiệu hóa sau khi được phiên âm (transcription). Ở trong bạch cầu trung tính những MMPs (MMP-8, MMP-9) được lưu trữ dưới dạng hạt nội bào và Preenzyme (pro-enzyme). Sự bài tiết ra ngoài tế bào của chúng được kích thích bởi những tín hiệu bên ngoài (truyền tín hiệu cytokine hoặc truyền tín hiệu CD40). Trên bề mặt tế bào nó tồn tại dưới dạng MMP14-TIMP2-pro-MMP2 và khả năng hoạt động của pro-MMP2. Cuối cùng là các protein được hoạt hóa ức chế bởi TIMPs có ở môi trường ngoại bào.
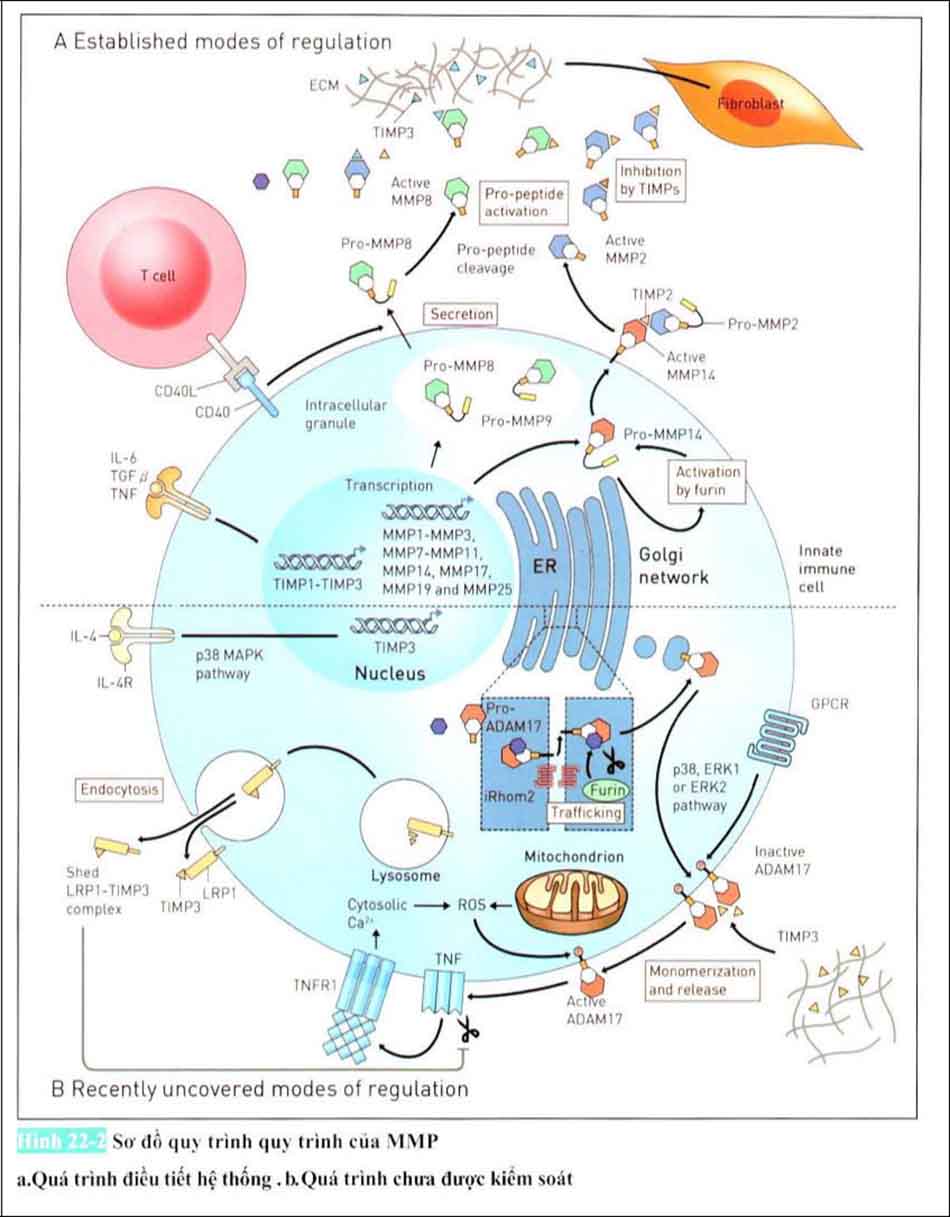
Gần đây đã có báo cáo rằng sự truyền tín hiệu của thụ thể Interleukin 4 ở đại thực bào cũng như tế bào đuôi gai chưa trưởng thành gây ra biểu hiện của TIMP3 qua trung gian p38. TIMP3 được tồn tại dưới dạng bể chứa cabon ở trong môi trường tốt để kết hợp vs hyaluronic sau khi tiết ra từ các tế bào. ADAM metallicopeptidase miền 17 (ADAM 17) được phiên mã dưới dạng tiền chất bất hoạt ER. Pro-ADAM17 được hoạt hóa bởi Purine Shear Protein Converting Enzyme sau khi di chuyển đồng bộ máy Golgi.
ADAM 17 ở bề mặt tế bào bị bất hoạt ở dạng Homo dimer và dường như liên quan đến T1MP3. Được kích hoạt bởi Thụ thể bắt cặp với G protein do những kích thích khác, dường như hoạt hóa của ADMA17 để tách Monomer ( phân tử đơn vị nhỏ ) ADAM 17 từ TIMP3 bằng cách Phosphoryl hóa của đuôi chất tế bào của ADAM 17 cũng như ERK2. ERK1 (Kinase 1 được kích hoạt tín hiệu ngoại bào) , MAPKs (Mitogen-Activated Protein Kinase). Các loài oxy phản ứng từ các ty thể được tạo ra bằng cách kích hoạt Phosphoryl hóa ở đuôi nội chất tế bào của monomer ADAM 17 ở thành tế bào. ADAM 17 đã được hoạt hóa sẽ kích hoạt Yếu tố hoại tử khối u (Tumour Necrosis Factor, TNF), Yếu tố hoại tử khối u ở 1 thụ thể Yếu tố hoại tư khối u sản sinh các gốc tự do từ các ty thể để tăng nồng độ ion canxi của nội chất tế bào để liên kết. Con đường yếu tố hoại tử khối u tăng cường tác động hấp thụ trung gian nội tế bào Các protein liên quan đến thụ thể lipoprotein mật độ thấp (Low-density Lipoprotein Receptor-related Protein 1, LPR1) gây ra nguyên nhân phân hủy bởi tiểu thể (Lysosome) của LRP1 liên kết với TIMP3.
Ở trong mô da được biểu hiện tiêu biểu bằng MMP-1, MMP-2, MMP-3, MMP-7, MMP-9, MMP-10, MMP-13, MMP-14, MMP-19, MMP-28. Tăng biểu hiện của Matrix Metalloproteinases ở mô tế bào có thể gây ra sự phân hủy của chất nền ngoại bào do chấn thương vật lý bằng phương pháp (chấn thương kim tiêm (needle injury), tổn thương nhiệt do thiết bị năng lượng (energy based device), tiêm HA) có thể được gây ra bằng những ứng dụng của Retinoid, truyền dung dịch thuốc qua da, cũng như tiêm tĩnh mạch triamcinolone, hoạt động của các chất ức chế tế bào Matrix Metalloproteinases. Yếu tố tăng của Matrix Metalloproteinases đại diện và yếu tố tăng cứa chất ức chế Matrix Metalloproteinases đã tóm tắt ở bảng 22-2.

Metal Matrix Proteinase có liên quan đến tăng sắc tố và lão hóa của da bằng cách phá hủy protein của mô da bao gồm protein chất nên ngoại bào. màng nền khác và Elastin, Collagen. Để ngăn ngừa lão hóa da thì sử dụng những sản phẩm Retinoids dạng bôi. kem chống nắng và điều trị làm giảm nếp nhăn sâu bằng cách siêu âm hội tụ cường độ cao ( HIFU). RF tần số cao, laser. chất làm đầy (filier), botox, lột da bằng hóa chất (peeling). Chất ức chế Metal Matrix Proteinase, có thể chờ đợi hiệu quả như mỹ phẩm bằng cách tác động lên da dưới dạng mặt nạ mặt. solution, thuốc mỡ, Lotion. cream như một thành phần thuốc hoặc thành phần mỹ phẩm và các chất ức chế Metal Matrix Proteinase dự kiến sẽ được áp dụng để ngăn ngừa và cải thiện các triệu chứng liên quan đến tổn thương do ánh sáng mặt trời hoặc lão hóa ánh sáng và giảm độ đàn hồi. tăng sắc tố, nếp nhăn. Các thuốc mới cho chất ức chế Matrix Metalloproteinases về mặt vật lý đang được sử dụng nỗ lực để sử dụng vào điều trị các bệnh về da.
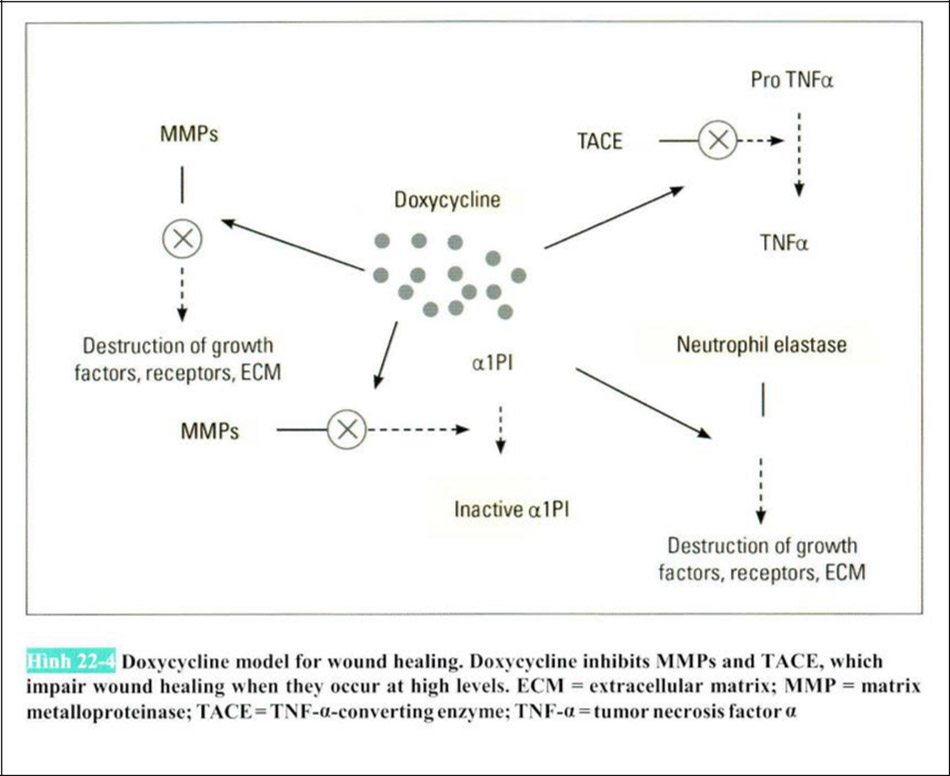
Để sử dụng với mục đích thẩm mỹ làm ức chế Matrix Metalloproteinases phải cần quá trình truyền vào trong da. Hầu hết các chất ức chế Matrix Metalloproteinases khó hòa tan trong dược phẩm hoặc mỹ phẩm và khó để sản xuất. Khi mà sử dụng như thuốc uống cần phải chú ý khả năng tác dụng phụ toàn thân và khó sử dụng có chọn lọc trên các phần như tăng sắc tố lão hóa.
Hoạt hóa chất ức chế Matrix Metalloproteinases nếu ngoại trừ steroid thì có kháng sinh tetracycline, trong y học có thể sử dụng trong mục đích thẩm mỹ. Thuốc uống bao gồm Minocycline, Doxy Cycling. Thuốc mỡ có Tetracycline, thuốc tiêm có Taizecycline, Doxycycline
Các chất có nguồn gốc từ chất kháng sinh Tetracycline (Chemically Modificd Tetracycle , CMT, Đại diện incyclinide) nếu được sử dụng như một chất ức chế Matrix Metalloproteinases thì Tetracycline tự kháng sinh nó loại bỏ vị trí có hiệu lực kháng sinh của chất kháng sinh Tetracycline cao, có khả năng xảy ra mất cân bằng của hệ thực vật bình thường và miễn dịch kháng sinh, bằng cách sửa đổi tính hóa học chỉ vị trí có tác dụng chất ức chế Matrix Metalloproteinases đã được thực hiện để thuốc mới đưa vào sử dụng.
Tài liệu tham khảo
1. Sang Eun Less,, Anti-aging Cosmetics and skin barrier, The Journal of Skin Barrier Research, Vol. 20No.l 2018
2. Lôffek, S., Schilling, O., & Franzke, C. W. (2011). Biological role of matrix metalloproteinases: a critical balance.
3. Visse R, Nagase H. Matrix metalloproteinases and tissue inhibitors of metalloproteinases: structure, function, and biochemistry. Circ Res 2003: 92: 827-839
4. Oblander SA. Zhou Z, Galvez BG, et al. Distinctive functions of membrane type 1 matrix-metalloprotease (MT1-MMP or MMP14) in lung and submandibular gland development are independent of its role in pro-MMP-2 activation. Dev Biol 2005: 277:255- 269.
5. Shi J. Son MY, Yamada S, et al. Membrane-type MMPs enable extracellular matrix permissiveness and mesenchymal cell proliferation during embryogenesis. Dev Biol 2008; 313:196-209.
6. Caterina JJ, Skobe Z, Shi .1, et al. Enamelysin (matrix metalloproteinase 20)-deficient mice display an amelogenesis imperfecta phenotype. .1 Biol Chem 2002; 277:49598-49604
7. Pendas AM, Folgueras AR. Llano E, et al. Diet-induced obesity and reduced skin cancer susceptibility in matrix metalloproteinase 19-deficient mice. Mol Cell Biol 2004: 24: 5304-5313
8. Rikimaru A, Komori K, Sakamoto T, cl al. Establishment of an MT4-MMP-deticient mouse strain representing an efficient tracking system for MT4-MMP/MMP-17 expression in vivo using betagalactosidase. Genes Cells 2007; 12: 1091-1100
9. English WR. Puente XS, Freije JM, et al. Membrane type 4 matrix metalloproteinase (MMP17) has tumor necrosis factor-a convertase activity but does not activate pro-MMP2. J Biol Chem 2000: 275: 14046-14055.
10. Munaut C. Salonurmi T. Kontusaari S, et al. Murine matrix metalloproteinase 9 gene. 59- upstream region contains cis-acting elements for expression in osteoclasts and migrating keratinocytes in transgenic mice. .1 Biol Chem 1999: 274: 5588-5596
11. Sadowski T. Dietrich S. Koschinsky F, et al. Matrix metalloproteinase 19 regulates insulinlike growth factor-mediated proliferation, migration, and adhesion in human keratinocytes through proteolysis of insulin-like growth factor binding protein-3. Mol Biol Cell 2003; 14: 4569-1580.
12. Marchenko GN. Marchenko ND. Strongin AY. The structure and regulation of the human and mouse matrix metalloproteinase-21 gene and protein. Biochem .1 2003:372: 503-515.
13. Pei D. Kang T. Qi H. Cysteine array matrix metalloproteinase (CAMMP)/MMP-23 is a type 11 transmembrane matrix metalloproteinase regulated by a single cleavage for both secretion and activation. .1 Biol Chem 2000; 275: 33988-33997
14. M.Ahokas K, Skoog T, Suomcla S, et al. Matrilysin-2 (matrix metalloproteinase-26) is upregulated in keratinocytes during wound repair and early skin carcinogenesis. .1 Invest Dermatol 2005; 124: 849-856
15. Stickens D, Behơnick D.I, Ortega N, et al. Altered endochơndral bone development in matrix metalloproteinase 13-deficient mice. Development 2004; 131:5883-5895. lô.Bernal F, Hartung HP, Kieseier BC. Tissue mRNA expression in rất of newly described matrix metalloproteinases. Biol Res 2005; 38:267-271
16. Lohi J, Wilson CL, Roby JD, et al. Epilysin, a novel human matrix metalloproteinase (MMP-28) expressed in testis and keratinocytes and in response to injury. J Biol Chem 2001; 276: 10134- 10144.
17. Lukacova V, Zhang Y, Mackov M, et al. Similarity of binding sites of human matrix metalloproteinases. .1 Biol Chem 2004; 279: 14194-14200
18. Lakka SS, Gondi CS, Yanamandra N, et al. Inhibition of cathepsin B and MMP-9 gene expression in glioblastoma cell line via RNA interference reduces tumor cell invasion, tumor growth and angiogenesis. Oncogene 2004; 23: 4681-4689
19. Hasegawa S. Koshikawa N, Momiyama N, et al. Matrilysinspecific antisense oligonucleotide inhibits liver metastasis of human colon cancer cells in a nude mouse model. Int.! Cancer 1998; 76: 812-816
20. KHOKHA, Rama; MURTHY, Aditya; WEISS, Ashley. Metalloproteinases and their natural inhibitors in inflammation and immunity. Nature Reviews Immunology, 2013, 13.9: 649
21. Yang-lin H, Gao W, Hơng-ying L, Tang J (2016) The Role of the Mast Cell in Skin Aging. J Dermatol Res Ther 2:035
22. Stechmiller, J., Cowan, L., & Schultz, G. (2010). The role of doxycycline as a matrix metalloproteinase inhibitor for the treatment of chronic wounds. Biological research for nursing, 11(4), 336-344.
Xem thêm