Hiện trạng của bệnh viên gan C
Viêm gan siêu vi C (HCV) gây hại đến khoảng 4 triệu người ở Hoa Kỳ, trên thế giới ước tính là 180 triệu người mắc. Trong số những người bị nhiễm bệnh ở Hoa Kỳ, đại đa số bệnh ở dạng hoạt động.
Trong khi một số bệnh nhân, bệnh sẽ khỏi hoàn toàn, 75% bệnh nhân chuyển sang tình trạng mãn tính. Nhiễm HCV thường là âm thầm và những người bị ảnh hưởng thường không có triệu chứng trong suốt thời gian bị bệnh. Sự hoành hành của bệnh liên quan đến sự phát triển xơ gan, hiện đang gây hại đến hơn 600.000 người. Tử vong do nhiễm HCV là do biến chứng giai đoạn cuối của bệnh gan cũng như do sự phát triển của HCC.
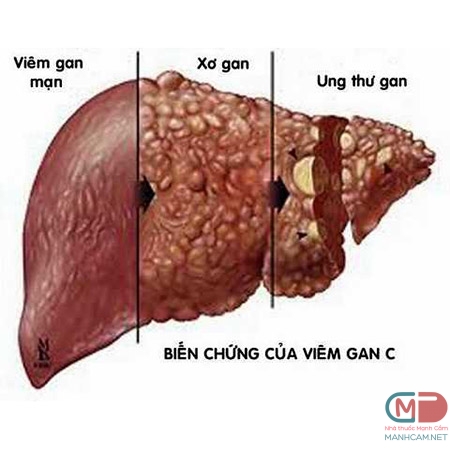
Tỷ lệ nhiễm mới HCV được chẩn đoán đã giảm xuống khoảng 17.000 trường hợp mỗi năm, chủ yếu là do tăng cường giám sát HCV trong các chế phẩm từ máu được bắt đầu tiến hành vào khoảng năm 1992.
Ngoài ra, nhận thức của con người về mối nguy hiểm khi sử dụng kim tiêm của người tiêm chích ma tuý tăng lên do đó đã giảm truyền nhiễm HCV. Tuy nhiên, nhiễm HCV vẫn xảy ra chủ yếu ở những người nghiện ma tuý. Dù vậy, tử vong do nhiễm HCV vẫn tiếp tục gia tăng do tiến triển lâm sàng của bệnh HCV.
Đặc điểm lâm sàng và chẩn đoán
Nhiễm HCV cấp tính thường không phát hiện được vì các triệu chứng không đặc hiệu bao gồm: chán ăn, đầy bụng, buồn nôn và nôn, cùng với tăng men gan và một số trường hợp vàng da. Vì vậy, không thể chuẩn đoán dựa trên các yếu tố nguy cơ và dấu hiệu lâm sàng.
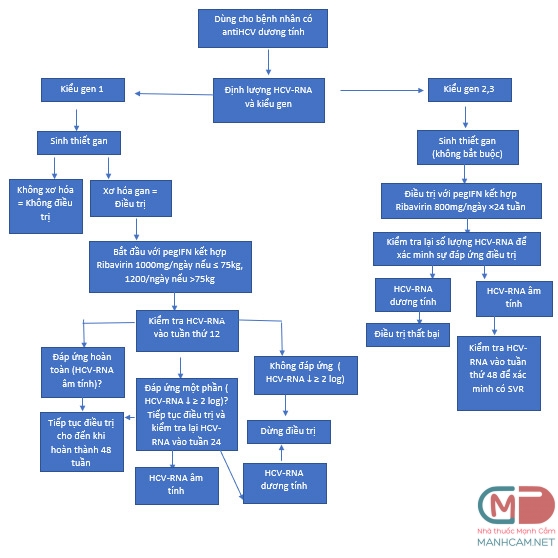
Xét nghiệm huyết thanh học khi xuất hiện các kháng thể antiHCV được chỉ định ở bất kỳ đối tượng có nguy cơ (Hình 1) và có tiếp xúc với bệnh. Xét nghiệm vi rút khi xuất hiện HCV-ribonucleic acid (HCV-RNA) và kiểu gen của virus cũng được chỉ định ở tất cả các bệnh nhân có kết quả dương tính với HCV, đặc biệt là ở những bệnh nhân đang được điều trị bằng thuốc kháng vi-rút.
Điều trị
Xác định kiểu gen HCV đặc hiệu của bệnh nhân là bắt buộc vì nó giúp dự đoán khả năng đáp ứng với liệu pháp dùng thuốc và cũng xác định thời gian điều trị tối ưu. Có tổng cộng sáu kiểu gen HCV khác nhau. Genotype 1 chiếm khoảng 70% bệnh ở Hoa Kỳ, tiếp theo là các kiểu gen 2 và 3. Genotype 1 có tỷ lệ kháng thuốc cao hơn và tỷ lệ đáp ứng điều trị thấp hơn với tỷ lệ ở những người bị nhiễm kiểu gen 2 hoặc 3.
Kiểu gen có giá trị trong việc đánh giá tỷ lệ nguy cơ / hiệu quả của liệu pháp kháng virus. Vì thuốc chống HCV như Ledvir, Myvelpa khiến cho bệnh nhân có nguy cơ bị nhiễm độc nặng, cần phải có một đánh giá toàn diện sức khoẻ và thể trạng của bệnh nhân để xác định xem có chống chỉ định điều trị hay không.
Chống chỉ định khi điều trị HCV bao gồm: viêm gan mất bù; mang thai; chứng trầm cảm không kiểm soát được hoặc tâm thần; tiền sử viêm gan tự miễn; các bệnh kèm theo không kiểm soát được như: chứng động kinh, rối loạn tuyến giáp, tiểu đường và bệnh động mạch vành; dưới 2 tuổi; thiếu máu; sau ghép nội tạng; hoặc không sử dụng biện pháp tránh thai.
Nói chung, bệnh nhân được xem xét cho điều trị HCV bao gồm những bệnh nhân người lớn bị nhiễm HCV mãn tính (≥ 6 tháng) có chứng viêm gan mãn tính dựa trên sinh thiết gan với bệnh gan còn bù và các chỉ số xét nghiệm huyết thanh. Ngoài ra, do tỷ lệ cao tác dụng phụ về thần kinh, tâm thần khi phối hợp ribavirin-INF ( trầm cảm và lo âu chiếm 1/10 bệnh nhân), bệnh nhân phải sẵn sàng điều trị và đảm bảo tuân thủ điều trị.
Điều trị bằng thuốc kháng vi-rút
pegIFN alpha tiêm dưới da kết hợp ribavirin đường uống là chủ lực để điều trị nhiễm virút HCV và chưa có bằng chứng cho thấy thuốc nào tốt hơn thuốc nào (xem hình 1). Có thể sử dụng IFN đơn độc trong các trường hợp bệnh nhân chống chỉ định với ribavirin, tuy nhiên ribavirin không nên dùng đơn độc. Mục tiêu điều trị bao gồm đáp ứng virus sớm (viết tắt là EVR tức khi HCV-RNA không phát hiện được sau 12 tuần điều trị), đáp ứng điều trị cuối cùng (ETR) và đáp ứng virus học kéo dài (viết tắt và SVR được xác định là không phát hiện HCV-RNA 24 tuần sau khi ngừng điều trị bằng thuốc kháng vi-rút). Mục tiêu bổ sung là giảm thiểu các độc tính có liên quan đến điều trị có thể xuất hiện đồng thời duy trì hiệu quả điều trị.
PegIFN được chấp thuận sử dụng ở Hoa Kỳ
pegINF alpha-2b và pegINF alpha-2a, đều có hiệu quả cao so với interferon chuẩn kết hợp ribavirin. Các sản phẩm này tương tự nhau đều bổ sung thêm nhiều chuỗi polyethylene glycol bên cạnh phân tử mẹ để tăng thời gian hoạt động dược lý. Cần lưu ý có sự khác biệt về liều lượng, tần suất, và cách thức mỗi sản phẩm kết hợp với ribavirin. PegINF alpha-2b kết hợp với ribavirin với liều tính theo cân nặng 1.5 mcg / kg, trong khi dùng một liều cố định 180 mcg với pegINF alpha-2a. Cả hai đều được tiêm dưới da hàng tuần.
INF alphacon-1 chuẩn cũng được chấp thuận để điều trị HCV theo liều cố định được tiêm dưới da 3 lần hàng tuần đơn độc hoặc kết hợp với ribavirin. Phản ứng có hại của INF là phổ biến và có thể dẫn đến không dung nạp thuốc ở bệnh nhân cũng như giảm hiệu quả do phải giảm liều. Độc tính ribavirin bao gồm: thiếu máu tan huyết, mệt mỏi, dị ứng da và gout. Ribavirin cũng gây sẩy thai, gây ung thư và gây quái thai. Do đó phải có biện pháp tránh thai phù hợp với bệnh nhân nữ cũng như phụ nữ ở tuổi sinh đẻ và nên kéo dài 6 tháng sau khi ngừng điều trị.
Kiểm tra và Theo dõi
Thời gian điều trị và theo dõi bệnh phụ thuộc vào kiểu gen của HCV, với genotype 1 thường đòi hỏi một đợt điều trị dài hơn. Ở những bệnh nhân bị bệnh genotype 1 bắt đầu dùng pegIFN / ribavirin, kiểm tra HCV-RNA vào tuần thứ 12 (xem hình 1). Bệnh nhân có đáp ứng virut sớm EVR nên tiếp tục hoàn thành điều trị 48 tuần và sau đó được đánh giá về đáp ứng điều trị cuối cùng ETR. Kiểm tra lại HCV-RNA vào tuần 24 sau khi ngừng điều trị để xác định đáp ứng virus bền vững SVR. Nếu EVR đáp ứng một phần ở tuần 12 (giảm HCV-RNA ≥2 log) nên tiếp tục điều trị thêm 12 tuần nữa. Xét nghiệm HCV-RNA âm tính ở tuần 24 có nghĩa là phải tiếp tục điều trị trong 48 tuần. Nếu không thấy đáp ứng sau 12 hoặc 24 tuần, thì nên ngưng điều trị. Ở bệnh nhân genotype 2 hoặc 3, HCV-RNA không được đánh giá cho đến khi điều trị xong 24 tuần. Nếu không phát hiện ra HCV-RNA, thì đánh giá SVR được thực hiện ở 48 tuần. Nếu HCV vẫn phát hiện được thì việc điều trị thất bại. Hiệu quả được xác định khi SVR khoảng 75% đối với kiểu gen 2 và 3 và 50% với kiểu gen 1.
Trong quá trình điều trị nên giám sát liên tục độc tính của INF và ribavirin. Công thức máu ban đầu, creatinine huyết thanh, men gan transaminase, hoocmon tuyến giáp thuyoidin (TSH), và xét nghiệm mang thai nên được đánh giá ở thời điểm bắt đầu điều trị. TSH nên được theo dõi 12 tuần một lần đối với điều trị, trong khi các chỉ định khác có thể được đánh giá hàng tháng trong 12 tuần đầu, sau đó cứ 2 tháng một lần cho đến khi kết thúc điều trị, trừ khi các biểu hiện độc tính cụ thể được đảm bảo theo dõi thường xuyên. Việc giảm liều hoặc ngừng điều trị ribavirin là cần thiết khi thiếu máu hoặc suy thận nặng. Cần giảm liều dùng pegIFN với người men gan tăng hoặc suy thận